2024年成考高起点理化综合模拟试卷及答案(二)
考试总分:145分
考试类型:模拟试题
作答时间:90分钟
已答人数:304
试卷答案:有
试卷介绍: 2024年成考高起点理化综合模拟试卷及答案(二)已经整理好,需要备考的朋友们赶紧来刷题吧!
试卷预览
-
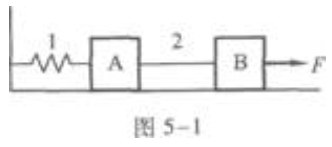
1. 如图5-1所示,在光滑的水平桌面上有质量为m的物体A和B,它们中间用细绳2连接,A的左端用弹簧l与墙连接,B的右端用水平恒力F拉住,使A和B静止不动。现把细绳2剪断,在剪断瞬间A、B的加速度是()。
A
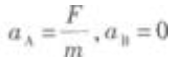
B
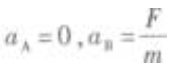
C
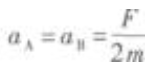
D
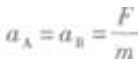
-
2. 一定质量的理想气体,在保持温度不变的过程中,吸收了热量,则气体的()。
A体积增大,内能改变
B体积减小,内能不变
C压强增大,内能改变
D压强减小,内能不变
-
3. 有a、b、C、d四只电阻,它们的U—I关系如图9—4所示,则图中电阻最大的是()。

Aa
Bb
CC
Dd
-
4. 光线从
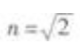 的介质射向空气,入射角
的介质射向空气,入射角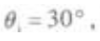 图6-5中所示的光路图中正确的是()。
图6-5中所示的光路图中正确的是()。 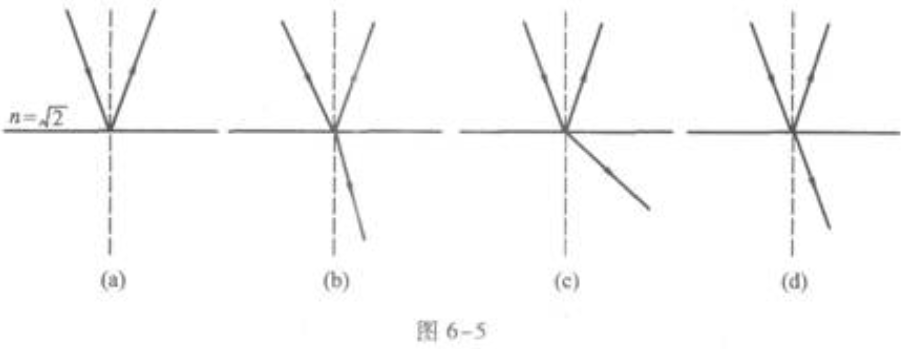
A(a)
B(b)
C(e)
D(d)
-
5. 把铁和铜的混合物放入稀硝酸中,反应完全后铜有剩余,则此溶液中存在()。
AFe(NO3)3
BFe(NO3)2
CFe(NO3)2和Cu(NO3)2
DFe(NO3)3和Cu(NO3)2
-
6. R元素的最高价氧化物的分子式是R2O5,R的气态化物在标准状况下466ml的质量是0.354g,则R元素的相对原子质量是()
A31
B75
C122
D14
-
7. 在已经处于化学平衡状态的体系中,如果下列量发生改变,其中一定能表明平衡移动的是()。
A反应混合物的浓度
B反应物的转化率
C正逆反应速率
D反应混合物的压强
-
8. 对于平衡体系
 (正反应为放热反应),其他条件不变时,增加压强,C的含量减小,则()
(正反应为放热反应),其他条件不变时,增加压强,C的含量减小,则()Ax+y
Bx+y>m+n
Cx
Dx>m+n
-
9. 有X、Y、Z三种金属,把X和Y,X和Z分别组成原电池的两极,X都是原电池的正极;把X、Y、Z分别浸入盐酸,只有Z被盐酸溶解。这三种金属的活动性由强到弱的顺序可能是()。
AX、Y、Z
BY、Z、X
CX、Z、Y
DZ、Y、X
-
10. 质量相同的SO2和SO3,它们中所含氧原子个数之比为()。
A4:5
B5:4
C5:6
D2:3
-
11. 下列关于Cl2的描述,正确的是()。
ACl2以液态形式存在时可称作氯水或液氯
B红热的铜丝在氯气中燃烧后生成蓝色的CuCl2
C氯气既可作氧化剂又可作还原剂
DFe在Cl2中燃烧生成FeCl2
-
12. 在下列烷烃的命名中,正确的是()。
A
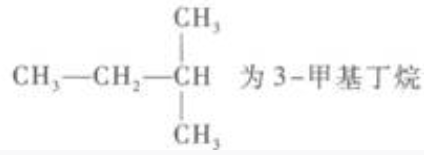
B
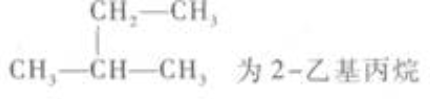
C

D
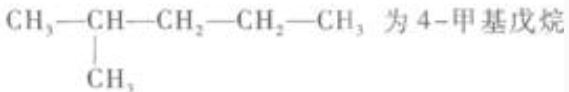
-
13. 在有催化剂存在和加热的条件下,
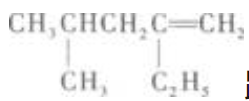 跟氢气发生加成反应,其产物的名称为()。
跟氢气发生加成反应,其产物的名称为()。A4-甲基-2-乙基戊烷
B3,5-二甲基己烷
C2-乙基-4-甲基戊烷
D2,4-二甲基己烷
-
14. 标准状况下,15g某气体的分子数与14gCO的分子数相等,则该气体是()。
AHF
BH2S
CNO
DNH3
-
15. 下列关于惯性的说法中正确的是()。
A物体只有静止或做匀速直线运动时才有惯性
B物体只有受外力作用时才有惯性
C物体的运动速度大时惯性大
D物体在任何情况下都有惯性
-
1. 某有机物1.6g,充分燃烧后,生成了1.12 L(标准状况下)二氧化碳和0.1 mol水。它的蒸气对空气的相对密度为1.1,试确定它的分子式。
-
2. 将9.76gFe和Fe2O3的混合物加入到70 mL的稀H2SO4中,恰好完全反应,并得到标准状况下的H2448 mL。向反应后的溶液中滴入KSCN溶液,未见血红色。请计算: (1)混合物中Fe和Fe2O3的质量。 (2)原稀H2SO4的物质的量浓度。
-
3. 往50 mL稀硫酸和稀盐酸的混合溶液中加入2.1375g氢氧化钡粉末,充分反应后进行过滤,测得滤液的pH=13,其沉淀干燥后质量为1.165g。试计算原混合溶液中
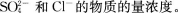
-
4. 常温常压下将20.0 g 14.0%的NaCl溶液,和30.0g 24.0%的NaCl溶液混合,得到密度为1.15 g/cm3的混合溶液,试计算: (1)该混合液的质量分数。 (2)该混合液的物质的量浓度。
-
5. 某液态有机物9.2g与足量氧气在密闭容器中燃烧,所得产物有CO、CO2和水蒸气。将混合气体通过浓硫酸时,浓硫酸增重10.89。剩余气体通过红热的氧化铜时,氧化铜减轻3.2g。剩余气体再通过石灰水时,石灰水质量增加17.6g。求此有机物的最简式。
-
6. 某铜银合金0.3g,溶于硝酸后,加入0.1 mol/L NaCl溶液21 mL,恰好使银完全沉淀,计算合金中铜和银的质量分数。
-
7. 一个中子以2×107m/s的速度撞到一个静止的未知的原子核上,并以1.7×107m/s的速度被反弹回来,而这个未知的原子核得到了0.31×107m/s的速度,那么,未知的原子核的质量是中子的多少倍呢?
-
8. 如图所示,质量为m的子弹水平地射入质量为m´的沙箱后与沙箱一起摆动的最大偏角是θ,绳长为L,求: (1)子弹射人沙箱时的速度; (2)绳承受的最大拉力.
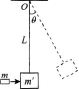
-
9. 如图所示的电路中,电源电动势E=12 V,内阻r=1Ω,外电阻R1=R2=4Ω,R3=R4=6Ω,问: (1)S1闭合,S2断开时路端电压多大? (2)S1断开,S2闭合时R2消耗的功率多大?
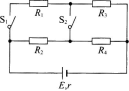
-
10. 60kg的物体以2m/s的速度竖直匀速下降,若向上的力突然变为617.4N,并持续2s,求物体在这2s内下降的高度。
-
11. 一人站在10m高的台上,把质量为0.4kg的物体以5m/s的速度抛出,物体落地时的速度为14m/s。试求物体克服空气阻力所做的功。(g取10m/s2)
-
12. Na2CO3·l0H2O放在敞口容器内会逐渐变成粉末,这现象称为(),而NaOH固体放置时表面会形成溶液,这现象称为().
-
13. 明矾水溶液呈酸性的离子方程式是______,出现浑浊时,消除的方法是______;纯碱与水作用的离子方程式是______,若要增强其洗涤力应______。
相关试卷
-
2024年成考高起点每日一练《理化综合》7月30日616人做过
-
2024年成考高起点每日一练《理化综合》7月31日1261人做过
-
2024年成考高起点每日一练《理化综合》8月1日265人做过
-
2024年成考高起点每日一练《理化综合》8月2日816人做过
-
2024年成考高起点每日一练《理化综合》8月3日1915人做过
-
2024年成考高起点每日一练《理化综合》8月4日1399人做过
-
2024年成考高起点每日一练《理化综合》8月5日1940人做过
-
2024年成考高起点每日一练《理化综合》8月6日419人做过
-
2024年成考高起点每日一练《理化综合》8月7日403人做过
-
2024年成考高起点每日一练《理化综合》8月8日735人做过
相关题库