某反应ΔH>0,当反应达到平衡后升高温度,则反应的ΔrGm?的变化是( )。
查看答案
相关试题
换一换


某反应ΔH>0,当反应达到平衡后升高温度,则反应的ΔrGm?的变化是( )。
答案
若升高温度后,反应的ΔrGmθ值升高,则此反应()。
A.ΔrHmθ>0 B.ΔrHmθ<0 C.ΔrSmθ>0 D.ΔrSmθ<0
答案
若某反应ΔH > 0,升高温度,平衡将如何移动()
A.正向 B.逆向 C.不动 D.无法判断
答案
升高温度,某化学反应的标准平衡常数增大,则此反应为放热反应
答案
下列可逆反应达到平衡后,升高温度或减小压强,平衡都向正反应方向移动的是()。
A.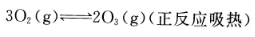 B.
B.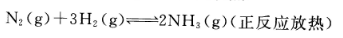 C.
C.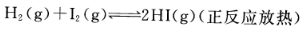 D.
D.
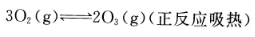 B.
B.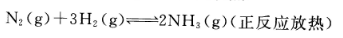 C.
C.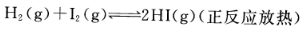 D.
D.
答案
下列可逆反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是()。
A.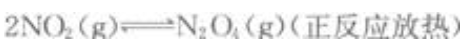 B.
B.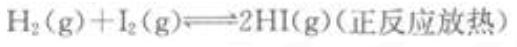 C.
C.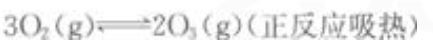 D.
D.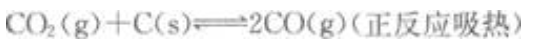
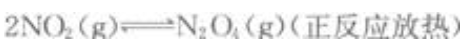 B.
B.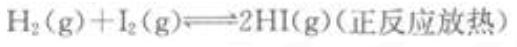 C.
C.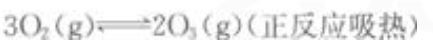 D.
D.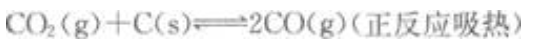
答案
如果某反应的ΔrGmө< 0,则反应在标态下将()
A.自发进行 B.处于平衡状态 C.不进行 D.是放热的
答案
对于DH < 0的反应,升高温度,平衡常数如何改变()
A.增大 B.减小 C.不变 D.无法判断
答案
中国大学MOOC: 升高温度后,某化学反应的平衡常数变大,则此反应:(2018-2019年A卷)
答案
对于可逆反应,达到化学平衡时,若升高温度,则化学平衡左移()
A.正、逆反应速度加快,V逆>V正 B.正、逆反应速度降低,V逆>V正 C.正、逆反应速度加快,V正>V逆 D.正、逆反应速度降低,V正>V逆
答案
热门试题
已知某化学反应是吸热反应,如果升高温度,则对反应的反应速率系数k和标准平衡常数KӨ的影响是()
在标准状态下,某反应的ΔrGmΘ,正向反应不自发,加入催化剂后该反应的活化能大大降低,则正向反应ΔrGmΘ( )(填“>0”、“<0”或“不变”)。
某反应?H>0,?S>0,则该反应
某反应∆H>0,∆S>0,则该反应()
一个吸热的的化学反应在达到平衡后,温度升高,则平衡向正反应方向进行,正逆反应速度同时提高()
CO变换反应是个可逆的放热反应,升高温度,平衡向正反应方向移动
CO变换反应是个可逆的放热反应,升高温度,平衡向正反应方向移动()
对于反应后分子数增加的反应,提高反应的平衡产率的方法有升高温度()
升高温度,增大吸热反应的正方向反应速率,减小逆方向反应速率,所以反应平衡向正向移动()
当升高温度时,可使吸热反应速率( );使放热反应速率( )。
现有四个化学反应,在标准状态下,反应的自由能变化分别为ΔrGmø⑴,ΔrGmø⑵,ΔrGmø⑶,ΔrGmø⑷,且有ΔrGmø⑴=ΔrGmø⑵-ΔrGmø⑶+2ΔrGmø⑷,则这四个反应的平衡常数之间的关系为()
若已知某化学反应的ΔrCP, m < 0,则该反应的ΔrSmθ随温度升高而( )。
当放热的可逆反应达到平衡时,温度升高10℃,则平衡常数会降低一半()
某反应为放热反应,当体系温度升高时,正反应速率减慢()
升高温度,化学平衡将向吸热反应方向移动。()
升高温度,化学反应的标准平衡常数K?增大()
升高温度,化学反应的标准平衡常数KӨ增大()
某化学反应在任何温度下都不能正向进行,则该反应的Δ H < 0 ,Δ S >?0 。
升高温度可以加快酯化反应,因此酯化反应温度越高越好()
升高温度使正反应速度增大,逆反应速度减小,结果平衡向右移动。



 使用微信扫一扫登录
使用微信扫一扫登录