按价键理论,下列分子中的中心原子在成键时须拆开电子对的是
查看答案
相关试题
换一换


按价键理论,下列分子中的中心原子在成键时须拆开电子对的是
答案
按价键理论,下列分子中的中心原子在成键时必须拆开电子对的是( )。
A.NCl3 B.H2O C.BCl3 D.SO2
答案
若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥理论,下列说法中正确的是:( ? )
答案
根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数
答案
价层电子对互斥理论是怎样确定中心原子的价层电子对数的?
答案
H3O+离子的中心原子O采用()杂化,其中有()个σ键和()个配位键,该中心原子的价层电子对构型为(),离子的几何构型()。
答案
下列分子中,其中心原子采取等性sp²杂化轨道成键的是()。
A.l₂Cl₆,分子中各原子不在同一平面 B.₂H₂,直线型分子 C.₂H₄,分子中各原子均在同一平面 D.NCl₃,原子不在同一平面
答案
下列分子或离子中,中心原子的最外层不含孤电子对的是
答案
下列分子中,中心原子不是采用sp^3d杂化轨道成键的是( )。
A.XeF2 B.ClF3 C.SF4 D.IF5
答案
在下列物质的分子中,中心原子采用sp杂化轨道成键,分子空间构型是直线型的是( )。
A.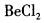 B.
B.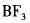 C.
C.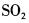 D.
D.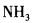
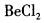 B.
B.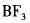 C.
C.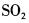 D.
D.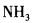
答案
热门试题
中心原子仅以sp杂化轨道成键的是
下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V形)的是
若ABn的中心原子A上没有孤对电子,运用价层电子对互斥模型,下列说法正确的是()
BeCl₂和OF₂同为AB₂型分子,它们的中心原子均采取sp杂化的方式成键。()
电负性就是分子中原子对成键电子对吸引力相对大小的量度()
按价键理论,苯分子中的6个碳原子均为sp2杂
分子轨道理论认为:中心原子的轨道与()群轨道之间发生了重叠,形成(),羰基配合物之所以稳定是由于羰基与中心原子之间形成()键所致
当分子的中心原子以s p 3 杂化成键时,分子的空间构型为四面体
凡是中心原子采用sp3d2杂化轨道成键的分子,其空间构型一定是八面体。
原子间通过共用电子对所形成的化学键叫()。
AB2型共价化合物,其中心原子均采用sp杂化轨道成键
电子对间夹角愈小,斥力愈大;且孤对电子间的斥力要大于成键电子对间的斥力
由两个原子核共用电子对所形成的键称为()。
SnCl2分子和H2O分子的空间构型均为V型,表明它们的中心原子采取相同方式的杂化轨道成键
「价键理论」中的「混成轨域」指的是中心原子本身的2~7个价层壳原子轨域重新混成产生不同几何形状的新原子轨域。这些新的原子轨域能阶相同(即为「简并状态」),而且依照「VSEPR」所预测的方位跟其它原子的原子轨域形成 σ 键。此叙述是否正确?
分子中,S原子成键的杂化轨道类型为()
价键理论认为形成化学键的电子只处于与此化学键相连的两个原子间的区域运动
在价键理论中,当原子轨道“头碰头”时,称为()成键轨道。
臭氧分子和二氧化硫分子具有类似的V形结构。中心原子都以sp2杂化,原子间除以σ键相连外,还存在∏34的离域π键。结构的主要不同点在于键长,键能和键角不同()
共价键断裂时,成键的一对电子保留在一个原子或基团上,这种键的断裂方式称为 ( )



 使用微信扫一扫登录
使用微信扫一扫登录